Cours pour la 5ème sur “Solubilité et miscibilité”
Chapitre 4– Solubilité et Miscibilité
- MODULE 1 – La constitution de la matière
- THEME 1 : Organisation et transformations de la matière
I/ Solubilité des solides dans les liquides
- Notion de dissolution
Démarche d’investigation : Comment dissoudre un médicament dans un verre d’eau ?
- Quand on met du sel en petite quantité dans l’eau, on obtient un mélange homogène. Le sel est donc un solide soluble dans l’eau : on dit qu’il s’est dissout dans l’eau. Dans le cas contraire, on dit qu’il est insoluble.
- L’espèce dissoute est appelée le soluté et le liquide dans lequel il est introduit est appelé le solvant. L’ensemble forme une solution.
- A partir d’une certaine masse de sel dissout dans un volume donné d’eau, le sel ajouté ne se dissout plus. Le mélange obtenu devient hétérogène : on dit que la solution est saturée.
- La solubilité s d’une espèce chimique dans l’eau est la masse maximale de cette espèce chimique que l’on peut dissoudre pour fabriquer un litre de solution.
La solubilité de l’espèce soluble s’exprime par :
Remarque : la solubilité d’une espèce chimique dépend entre autre de la température (ex du sel dans l’eau: s=358,5 g·L-1 à 20 °C, s=380,5 g·L-1 à 80 °C) et du solvant (ex : le sel est soluble dans l’eau et insoluble dans l’acide chlorhydrique).
- Conservation de la masse au cours d’une dissolution
Masse et volume
Démarche d’investigation : L’anniv de Théo
- L’unité internationale de masse est le kilogramme, de symbole kg.
- L’unité internationale de volume est le mètre cube (m3). On utilise plus souvent d’autres unités de capacité comme le Litre (L) et ses sous-multiples :
1L = 1000 ml = 1 dm3
1mL = 1 cm3
| m3 | dm3 | cm3 | ||||
| (kL) | hL | daL | L | dL | cL | mL |
- La masse d’un litre (1 L) d’eau est 1000 g soit 1 kg.
Conservation de la masse
Démarche d’investigation : Une recette de sirop
- Lorsqu’on ajoute du sel dans l’eau, la masse de la solution d’eau salée est égale à la somme des masses de l’eau bouillante et des pincées de sel.
- La masse du sel et celle de l’eau ne change pas au cours de la dissolution : la masse se conserve.
Interprétation microscopique :
Le nombre de particules microscopiques reste inchangé lors d’une dissolution donc la masse est conservée.
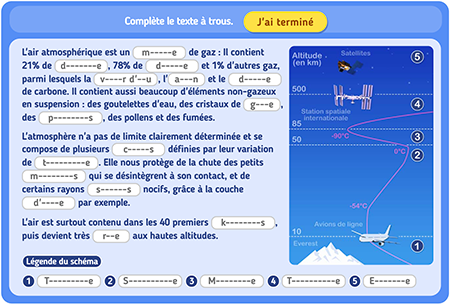
II- Solubilité des gaz dans les liquides
Activité expérimentale : Un soda
- Un gaz peut se dissoudre dans un liquide. De ce fait, le gaz est le soluté et le liquide est le solvant.
- On peut trouver des eaux avec des gaz dissous naturellement (source d’eau pétillante) ou artificiellement (sodas).
- Le gaz dissous dans les boissons pétillantes est le dioxyde de carbone.
- On trouve aussi le dioxygène dissout provenant de l’atmosphère.
- Pour récupérer le gaz dissous, on utilise un montage par déplacement d’eau.
- Pour mettre en évidence le dioxyde de carbone, on utilise le test à l’eau de chaux. En présence de dioxyde de carbone, l’eau de chaux se trouble.
III- Miscibilité des liquides
Activité expérimentale : Tous les liquides se mélangent-ils avec l’eau ?
- Lorsque l’on prépare un sirop à l’eau, l’eau et le sirop se mélangent
Il en est de même d’un mélange d’eau et de vinaigre. Ces mélanges sont homogènes : on dit que les liquides sont miscibles entre eux.
- Cependant, l’huile et le vinaigre ou même l’eau et l’huile ne se mélangent pas. Ces mélanges sont hétérogènes et les liquides sont dits non miscibles entre eux.
- Certains liquides, comme l’huile et le pétrole, sont non miscibles avec l’eau mais sont miscibles entre eux.
- Pour séparer deux liquides non miscibles, on utilise une ampoule à décanter.
Dans ce chapitre 4 consacré à la solubilité et la miscibilité, vous trouverez également :
- Feuille d’exercices
- Activité expérimentale : Tous les liquides se mélangent-ils avec l’eau ?
- Activité expérimentale : Un soda
- Démarche d’investigation : Une recette de sirop
- Démarche d’investigation : Comment dissoudre un médicament dans un verre d’eau ?
- Démarche d’investigation : L’anniv de Théo